在人口老齡化加速與全民健康意識提升的雙重驅動下,康復器械行業正迎來前所未有的發展機遇。然而,伴隨市場擴容而來的是對產品安全性與有效性的更高要求。如何精準判斷一款康復器械是否合規?這不僅關乎企業生存發展,更直接關系到使用者的生命健康。本文將深入解讀康復器械行業的核心標準體系,結合最新政策動向與行業實踐,系統梳理產品合規性的判斷維度與實操要點。
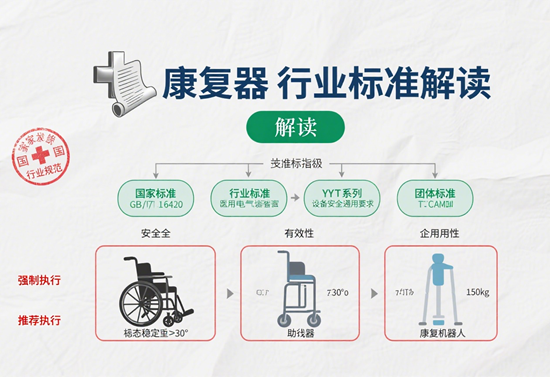
康復器械的合規性判斷,首先需立足于國家構建的嚴密法規標準體系。2021年6月1日起施行的《醫療器械監督管理條例》(國務院令第739號)是行業根本大法,明確了醫療器械全生命周期的監管要求,涵蓋研制、生產、經營、使用各環節。緊隨其后,《醫療器械臨床使用管理辦法》(國家衛健委令第8號)于2021年3月1日實施,對醫療機構在臨床應用康復器械時的安全管理、規范使用提出了具體指引。這兩部法規構成了產品合規的“雙支柱”。在國家標準層面,GB/T 41697-2022《康復輔助器具 一般要求和試驗方法》為產品性能、安全性、可靠性提供了統一的測試基準。而《養老機構康復輔助器具基本配置》國家標準的發布與實施(如2023年10月1日),則進一步細化了特定場景下康復器械的配置要求與合規邊界。企業必須確保產品同時滿足上位法規與具體標準的技術規范。
判斷產品合規性的核心維度,可從資質審查、技術驗證與法規符合性三方面系統把控。資質審查是源頭把控的關鍵。企業需嚴格核查產品是否取得有效的醫療器械注冊證或備案憑證,確認其分類(如一類、二類或三類)與實際風險等級匹配。生產企業的《醫療器械生產許可證》或備案憑證、經營企業的《醫療器械經營許可證》或備案憑證,以及質量管理體系認證(如ISO 13485)等資質文件,均需在有效期內且覆蓋對應產品范圍。技術驗證是合規性的實體支撐。這要求產品性能指標必須符合注冊/備案的技術要求,并通過型式檢驗報告予以證明。安全性驗證尤為關鍵,包括電氣安全(如GB 9706系列)、生物相容性(如GB/T 16886)、電磁兼容(如YY 0505)等強制標準檢測。產品說明書、標簽內容需與注冊批準文件完全一致,不得夸大療效或隱瞞風險。法規符合性則貫穿全流程。生產過程需符合《醫療器械生產質量管理規范》,確保可追溯性;經營與使用環節需遵守《醫療器械臨床使用管理辦法》,如建立設備驗收、維護、不良事件監測制度。廣告宣傳必須嚴守《廣告法》及醫療廣告專項規定,避免出現“根治”“無效退款”等絕對化用語。
時下行業熱點正深刻影響合規要求的內涵與外延。2025年全國兩會期間,“高端突破”“新技術應用”“設備更新”成為醫療器械領域的核心議題。這預示著融合人工智能、機器人技術的智能康復設備(如外骨骼機器人、腦機接口康復系統)將加速涌現,其合規性面臨新挑戰:除傳統安全標準外,還需關注算法透明度、數據隱私保護(如符合《個人信息保護法》)及人機交互安全性。市場監管總局近期發布的《經顱磁刺激治療設備校準規范》等醫療健康領域計量技術規范,凸顯了對創新型康復器械精準度與穩定性的更高要求。同時,中醫藥康復服務能力提升工程(2021-2025年)的推進,促使中醫類康復器械(如電針儀、艾灸設備)的合規性需同時滿足醫療器械法規與中醫藥特色標準。地方產業政策(如柳州市3億元投資的康復輔助器械生產項目)的落地,也要求企業在享受政策紅利時,同步強化合規建設,避免因標準理解偏差導致項目風險。
康復器械的合規性絕非靜態達標,而是動態適應法規演進與技術變革的持續過程。企業需建立“法規雷達”機制,實時跟蹤標準更新(如GB/T 41697-2022的修訂動態)與監管政策調整(如集采規則對產品成本與質量的新要求)。在產品設計階段即植入合規基因,通過風險管理(如ISO 14971應用)將標準要求轉化為技術參數。最終,唯有將合規視為企業生命線,在創新與規范間找到平衡點,方能在萬億級康復藍海中行穩致遠,真正守護萬千使用者的康復之路。